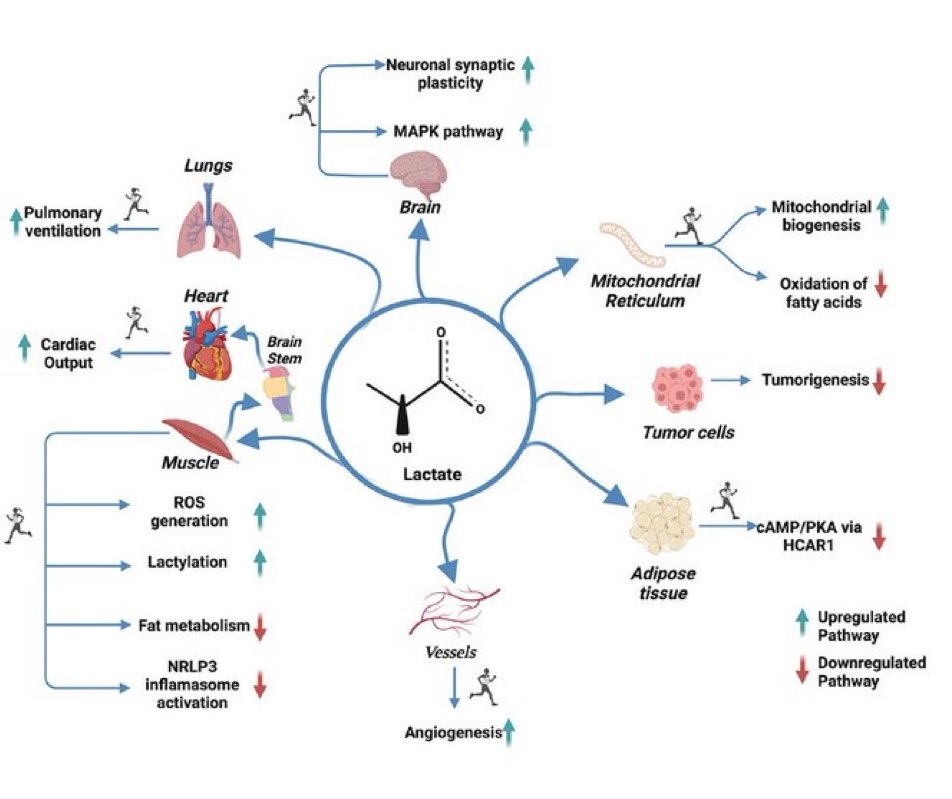
Durante una única sesión de ejercicio, el lactato ha dejado de interpretarse como un simple subproducto metabólico para ser considerado un regulador activo, dinámico y dependiente de la intensidad del metabolismo de los ácidos grasos. La evidencia reciente indica que el lactato actúa como una molécula señalizadora clave que conecta de forma bidireccional la síntesis y la degradación de lípidos, con efectos claramente específicos del tejido (tejido adiposo blanco vs. músculo esquelético). Esta regulación está modulada finamente por la concentración de lactato, el estado hormonal (especialmente catecolaminas), la densidad y tipo de receptores y la dinámica temporal de su acumulación, siendo la vía cAMP/PKA el eje central integrador.
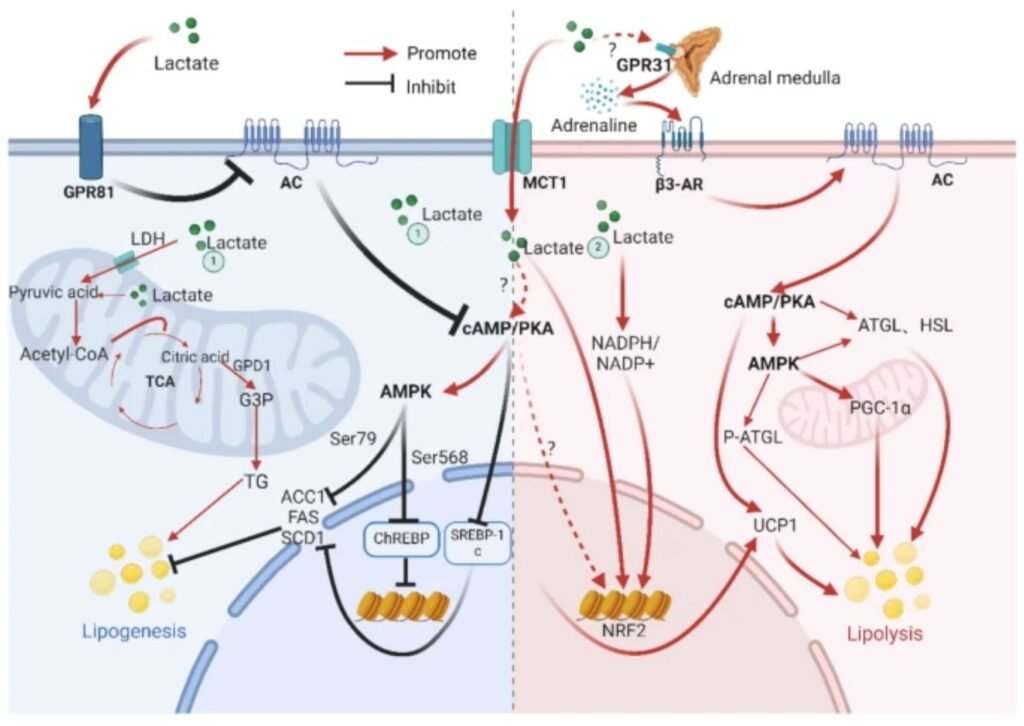
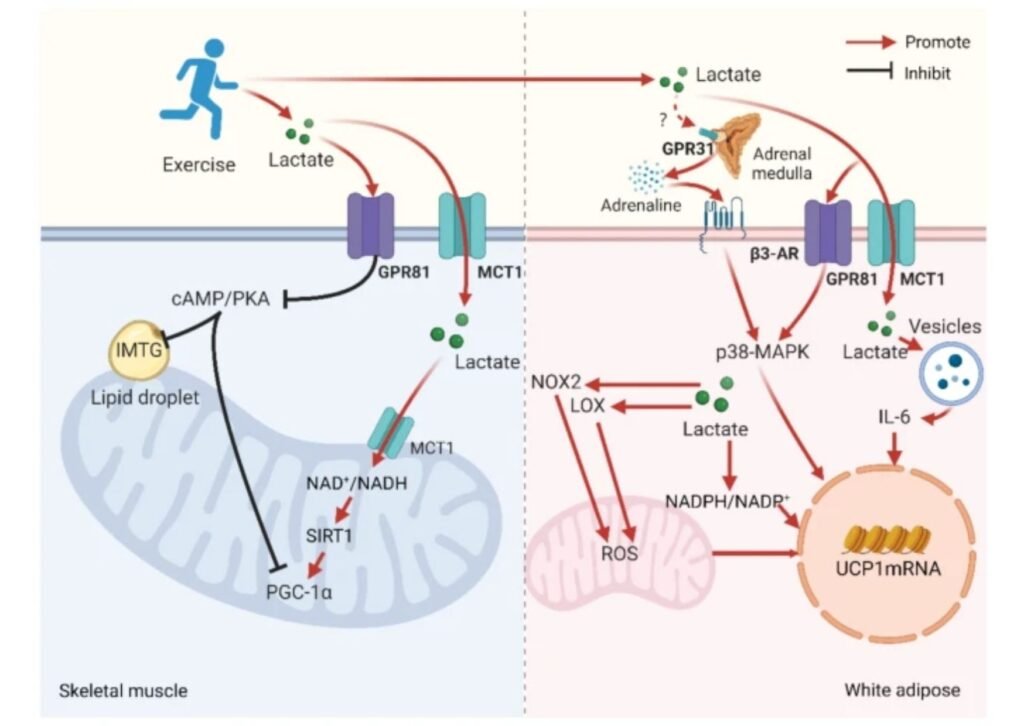
Uno de los aspectos más relevantes es la interacción compleja entre lactato y sistema simpático. Estudios clásicos en humanos mostraron que la infusión exógena y rápida de lactato (≥ 4 mM) puede suprimir la respuesta catecolaminérgica durante el ejercicio, probablemente mediante la activación de receptores periféricos inhibitorios como GPR81. Sin embargo, investigaciones más recientes sugieren que la acumulación endógena y progresiva de lactato durante el ejercicio (≈ 0–10 mM) podría, en determinados contextos, potenciar indirectamente la actividad simpática, posiblemente a través de quimiorreceptores centrales o periféricos (cuerpo carotídeo, hipotálamo). Esta aparente contradicción apunta a un comportamiento bifásico del lactato, altamente dependiente de su origen (endógeno vs. exógeno), velocidad de aparición y contexto fisiológico.
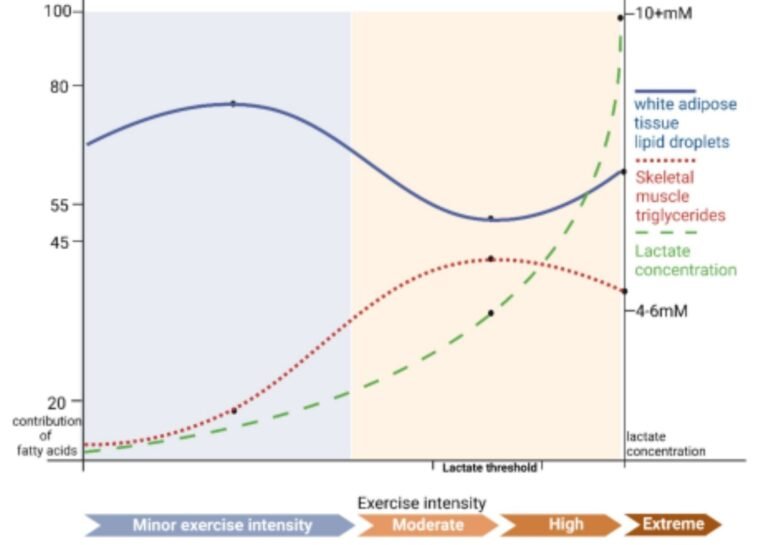
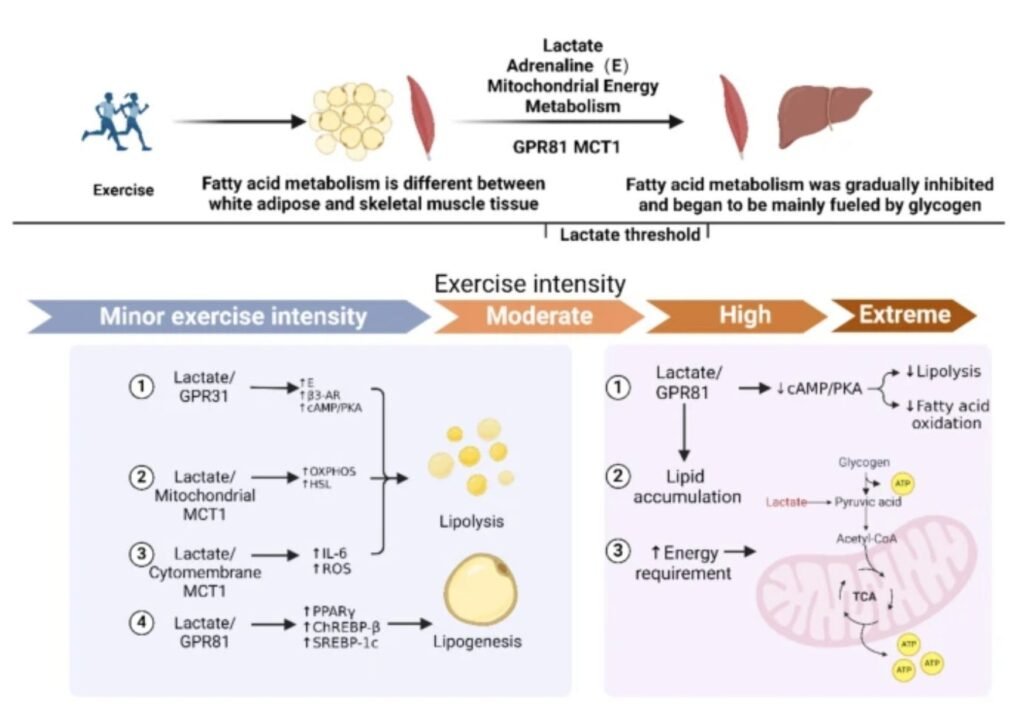
En el tejido adiposo blanco, el papel del lactato durante una sesión de ejercicio parece seguir un patrón dependiente de la intensidad:
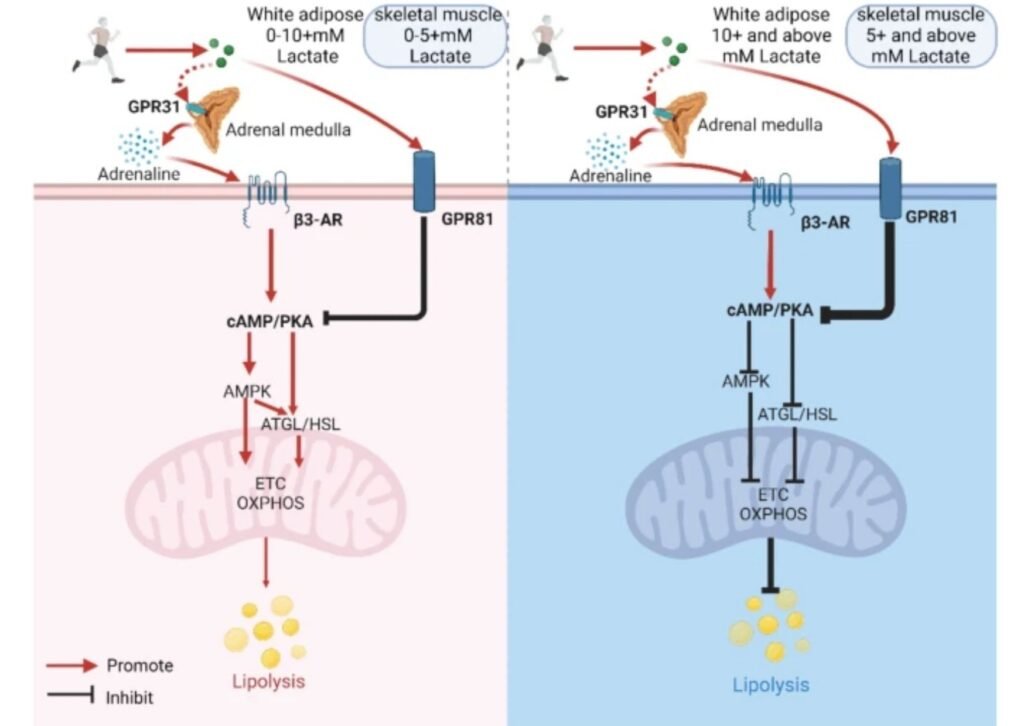
< 5 mM de lactato: predomina la lipólisis mediada por adrenalina a través del receptor β3-adrenérgico, impulsada principalmente por la activación simpática inducida por el ejercicio. En este rango, la señal inhibitoria del eje lactato–GPR81 es limitada.
≈ 5–10 mM: el lactato podría potenciar la acción y/o disponibilidad de la adrenalina, reforzando la activación de la vía cAMP/PKA vía β3-AR, con un efecto neto lipolítico. Evidencias previas indican que GPR81 no desempeña un papel dominante en la inhibición de la lipólisis en este rango de intensidades.
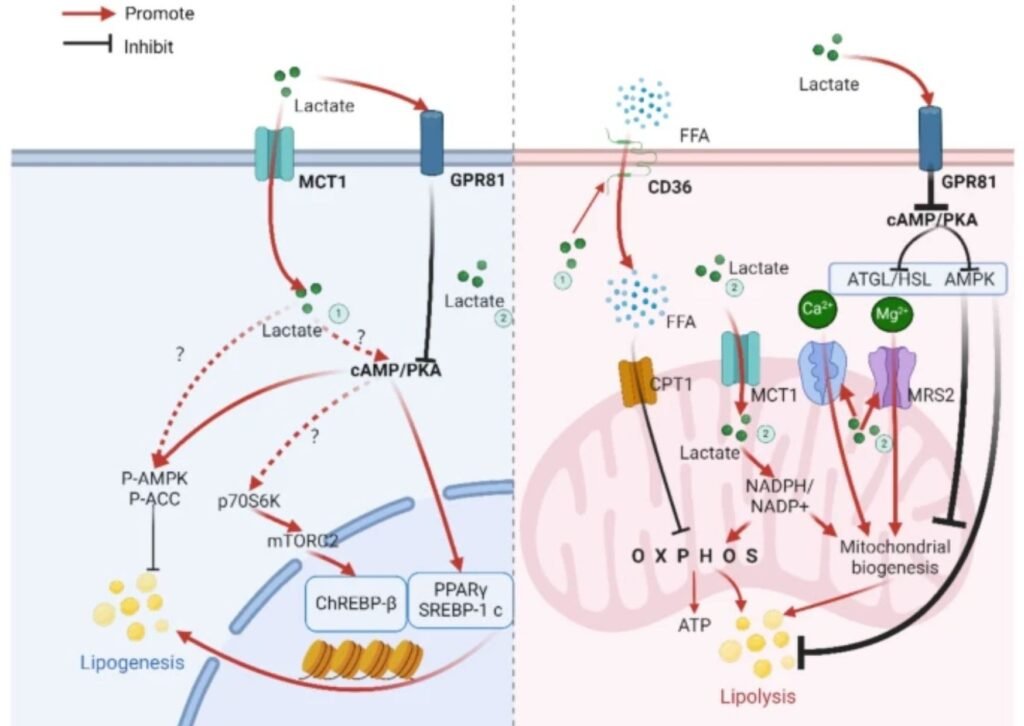
> 10 mM: el lactato se une extensamente a GPR81, inhibe la adenilato ciclasa, reduce la señalización cAMP/PKA y suprime la degradación de ácidos grasos, invirtiendo el efecto lipolítico previo.
En el músculo esquelético, la regulación es claramente distinta. Aunque las concentraciones séricas de adrenalina aumentan de forma continua con la intensidad del ejercicio, la señalización adrenérgica muscular es globalmente más débil que en el tejido adiposo y está más relacionada con glucogenólisis y metabolismo proteico que con la lipólisis directa. A nivel funcional:
Cuando el lactato alcanza ≈ 5 mM, se observa una reducción de la captación de ácidos grasos plasmáticos por el músculo y una contribución máxima de los triglicéridos intramusculares (IMTG) al suministro energético.
En este punto, la acción lipolítica de la adrenalina parece superar transitoriamente el efecto inhibitorio del lactato sobre GPR81.
Sin embargo, cuando el lactato supera ≈ 5 mM, el eje lactato–GPR81 comienza a dominar, limitando progresivamente la degradación de IMTG, incluso en presencia de niveles elevados de adrenalina. Esto explica por qué la contribución de los IMTG aumenta a intensidades moderadas, pero disminuye a intensidades elevadas, a pesar de la estimulación simpática sostenida.
En conjunto, el texto propone que el lactato actúa como un modulador fino, bifásico y tejido-específico del metabolismo lipídico durante el ejercicio, integrando señales metabólicas, hormonales y neuronales. No obstante, los autores subrayan que los umbrales de concentración propuestos son tentativos y dependen de múltiples variables (duración del ejercicio, expresión tisular de receptores, cinética de liberación y aclaramiento de catecolaminas). La evidencia en humanos sigue siendo limitada y, en ocasiones, contradictoria, lo que resalta la necesidad de estudios mecanísticos más controlados (por ejemplo, técnicas de lactate clamp y modelos con bloqueo específico de GPR81) para esclarecer definitivamente el papel regulador del lactato en la lipólisis durante el ejercicio.